Medical Device Regulation MDR
Les nouveaux règlements européens (UE) 2017/746 et (UE) 2017/745 imposent de nouvelles tâches aux participants de la chaîne d´approvisionnement pharmaceutique.
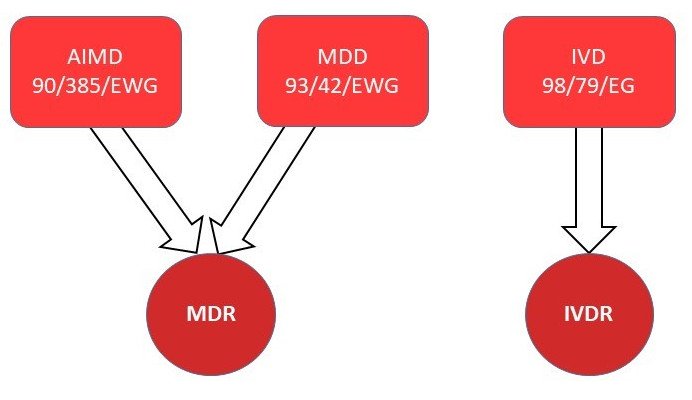
Règlement sur les dispositifs médicaux (Medical Device Regulation, MDR)
Le règlement sur les dispositifs médicaux (Medical Device Regulation MDR) a été adopté par le Parlement européen en avril 2017. Il a été publié le 05.05.2017 et est entré en vigueur le 25.05.2017. Le MDR dispose d´une période de transition jusqu´au 26 mai 2021.
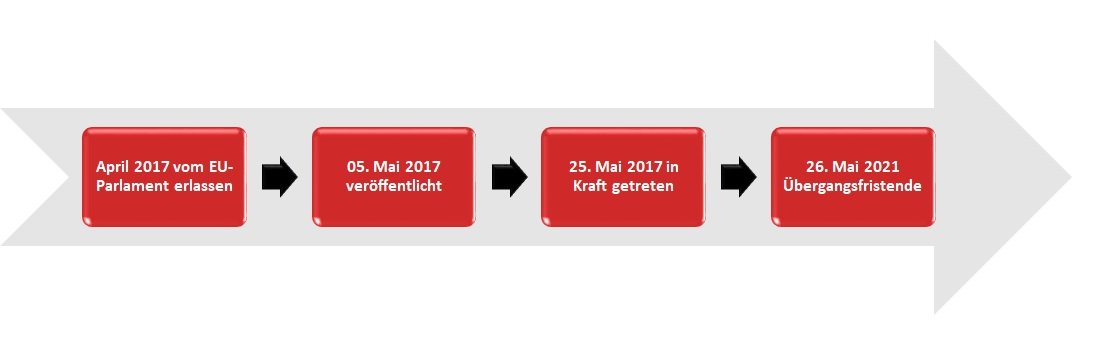
Qu´est-ce que la Medical Device Regulation MDR ?
Le Medical Device Regulation (MDR) est un règlement adopté par le Parlement européen afin de garantir la sécurité et le niveau élevé des dispositifs médicaux. Tout au long de la chaîne d´approvisionnement, les produits doivent être surveillés et scannés.
Pour ce faire, les produits seront munis d´un Unique Device Identifier (UDI). Le code scanné, accompagné d´informations supplémentaires à déclarer, devra à l´avenir être communiqué à la banque de données européenne des dispositifs médicaux (EUDAMED).
Le Medical Device Regulation remplace les deux directives suivantes :
Directive relative aux dispositifs médicaux (MDD) 93/42 CEE
Dispositif médical implantable actif (DMI) 90/385 CEE
Quels sont les objectifs de la Réglementation des dispositifs médicaux :
Le règlement vise à garantir le bon fonctionnement du marché intérieur des dispositifs médicaux. Les petites et moyennes entreprises seront particulièrement prises en compte.
En outre, le règlement fixe des normes élevées pour la qualité et la sécurité des dispositifs médicaux.
Les deux objectifs sont poursuivis en parallèle, ils sont indissociables et absolument de même importance.
Exceptions
Le règlement contient également des exceptions, car tous les produits ne doivent pas être scannés. L'exception concerne les produits IIa à III, si un certificat a été délivré avant la date de début de validité. Le certificat peut être valable jusqu'à 4 ans maximum après la date de début de validité. Cette phase de transition est appelée "soft transition". La finalité ou les caractéristiques de conception ne peuvent pas être modifiées, sinon le certificat devient caduc.
"Qu´est-ce qui est considéré comme un dispositif médical"
"Dispositif médical" désigne un instrument, un appareil, un dispositif, un logiciel, un implant, un réactif, un matériau ou un autre article qui, selon le fabricant, est destiné à des êtres humains. Ces produits sont destinés à sauver des vies, à aider à guérir et à améliorer la qualité de vie des personnes. Ce terme est défini à l´article 2, point 1, du règlement (UE) 2017/745.
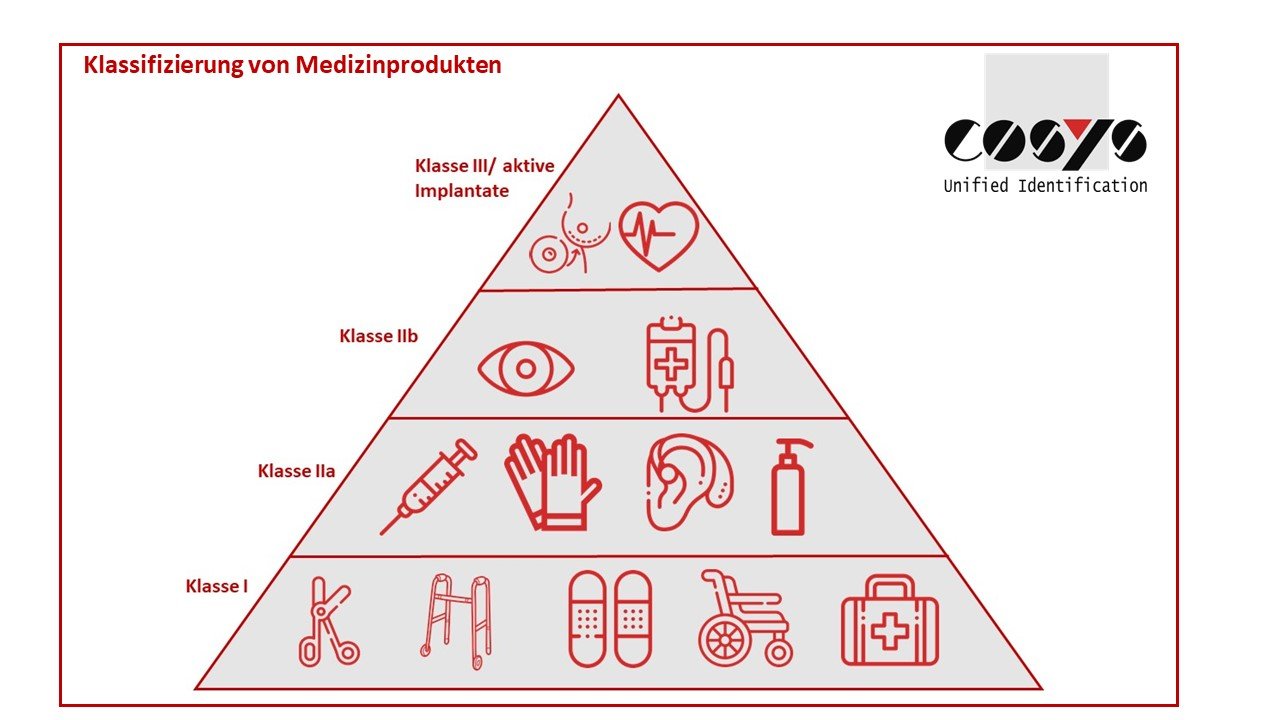
Selon la classification du dispositif médical, la réglementation de l´UE relative au MDR intervient sur l´axe temporel et exige une modification des processus ou des obligations de notification :
Classe 3 : à partir de 2022, classe 2 : à partir de 2023, classe 1 : à partir de 2025
Matériel d´information sur la directive européenne MDR / IVDR
Les règlements européens entraînent de nombreuses obligations et modifications pour tous les acteurs économiques. Pour que vous sachiez tout sur vos droits et obligations, COSYS a préparé pour vous de nombreux documents d´information. C´est avec plaisir que nous mettons nos informations à votre disposition !
Appareils de santé chez COSYS
La conformité au MDR et à l´IVDR commence avec le bon matériel. Seul un matériel professionnel de lecture de codes-barres garantit le respect des règlements de l´UE et permet une traçabilité sans faille des dispositifs médicaux et des produits de diagnostic in vitro tout au long de la chaîne d´approvisionnement. Le scannage des codes-barres et des codes Datamatrix permet d´assurer la traçabilité. C´est pourquoi les appareils SMD et les scanners manuels sont d´une grande importance pour les entreprises pharmaceutiques afin de satisfaire aux exigences de l´UE.
Avec COSYS, vous avez un partenaire compétent auprès duquel vous pouvez obtenir des conseils détaillés sur le matériel adéquat. Outre les appareils SMD classiques pour les conditions de travail difficiles, nous vous proposons également du matériel SMD spécialement adapté au secteur de la santé, afin que vous puissiez répondre aux exigences de l´UE.
Nos experts se feront un plaisir de vous consacrer du temps afin de trouver la solution matérielle parfaite pour vous !
Outre les solutions matérielles, l´appareil photo peut être utilisé pour capturer les codes à barres et les codes Datamatrix. Le logiciel COSYS Performance Scanning capture les codes à la vitesse de l´éclair, et l´appareil photo du smartphone peut être utilisé pour scanner les codes.
Avec COSYS, transformez vos smartphones, tablettes et wearables en véritables lecteurs de codes-barres de classe entreprise, adaptés à l´industrie et utilisables dans tous les secteurs de l´entreprise. Grâce aux algorithmes de reconnaissance d´image et à la puissance de calcul élevée des smartphones, les codes peuvent être scannés à une vitesse et une précision époustouflantes - bien plus rapidement et mieux que les scanners de codes à barres ordinaires.